Significantie
Scheikunde voor niveau havo 4, vwo 6, havo, vwo, havo 3, vwo 3, vmbo, havo 5, vwo 4, vwo 5, vmbo tl, 4, vwo, 6, vwo, 3, vwo, 4, vwo, 5
diagnostische vragen over significantie bij scheikunde
significantie, significante cijfers, derde klas, vmbo, havo, vwo
Hieronder zie je de dia’s inclusief toelichting. Gebruik de knop hieronder om de presentatie (Powerpoint) te downloaden.
Download presentatie (.pptx)
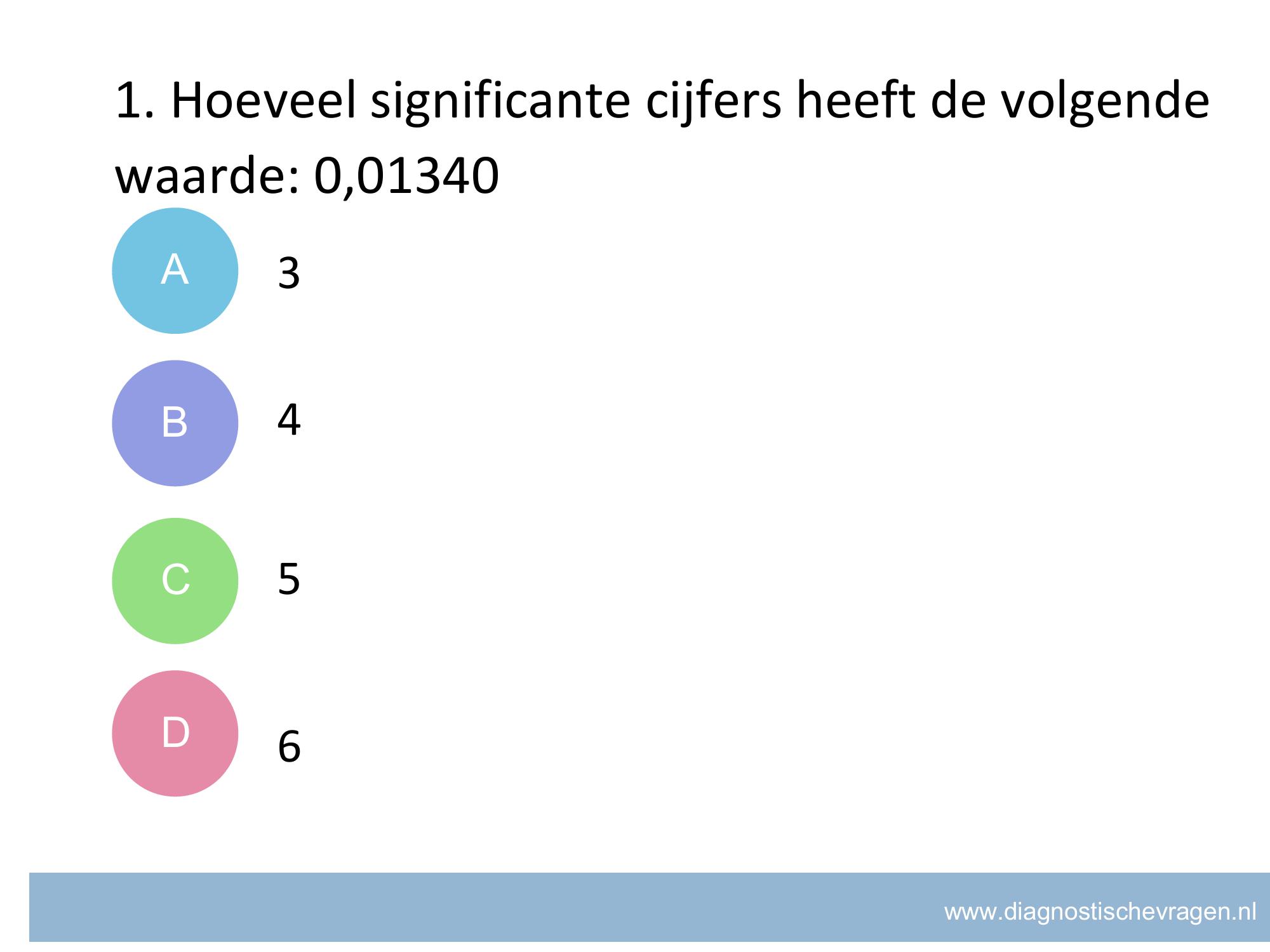
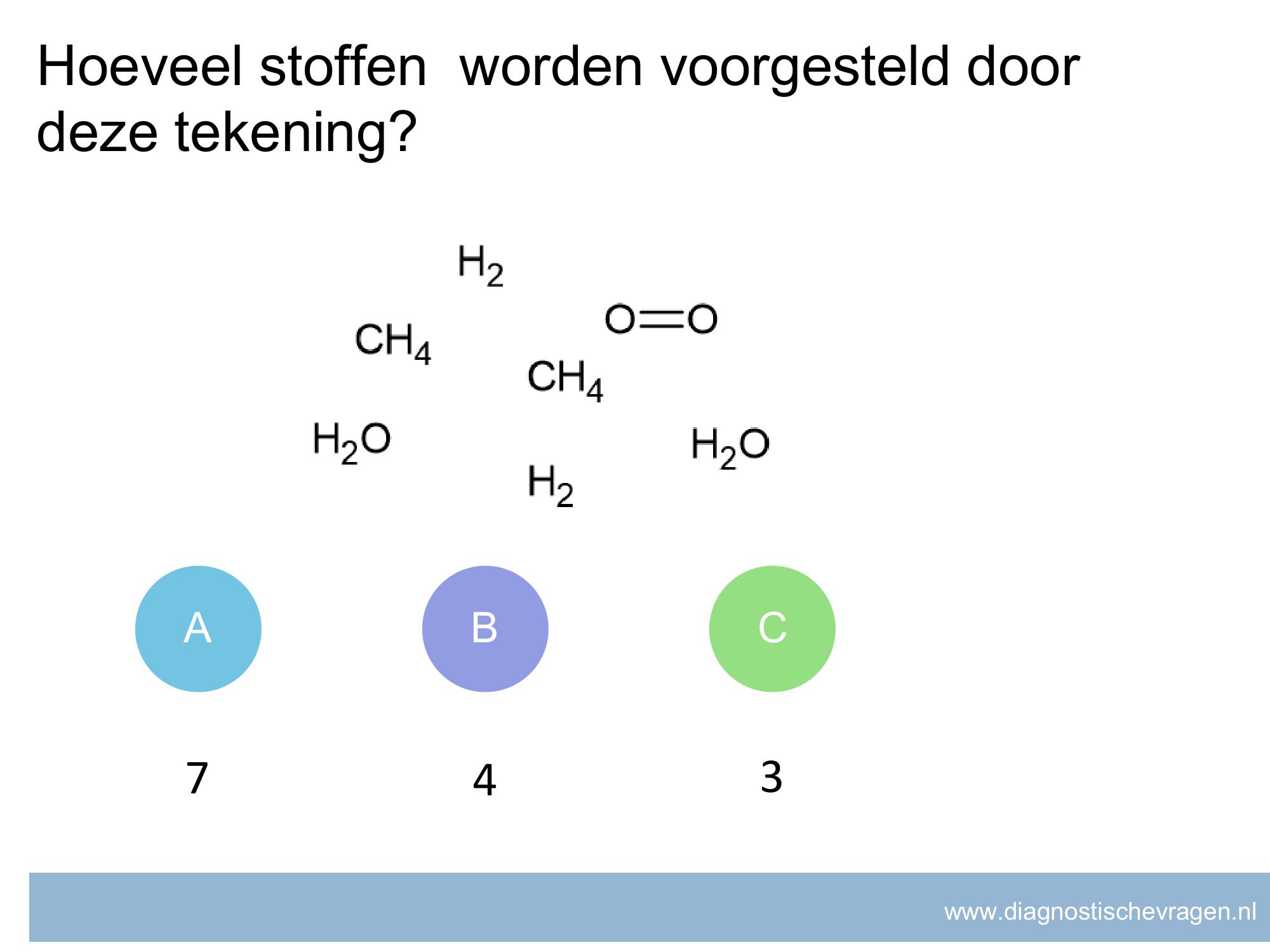
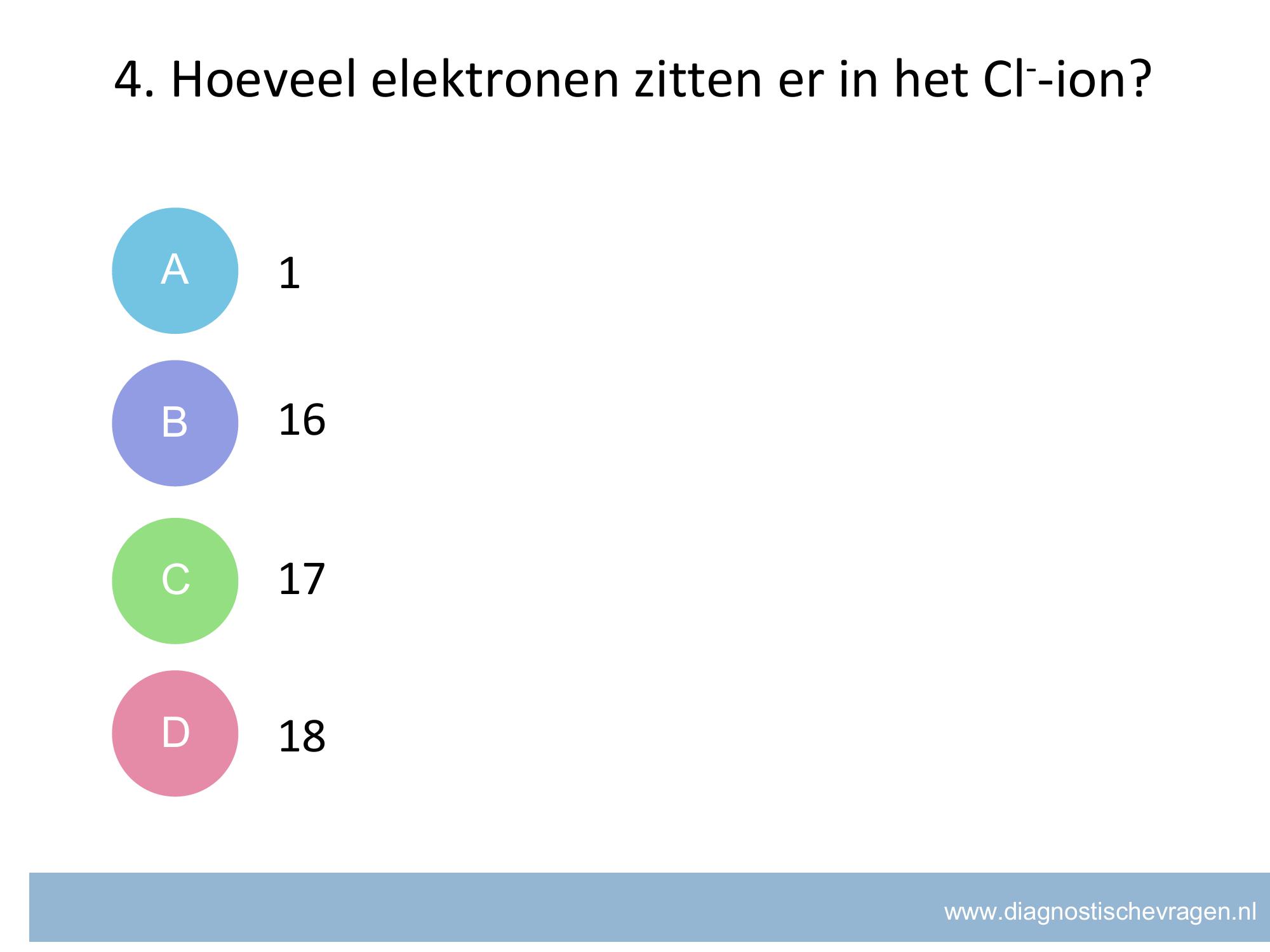
misvatting: leerlingen weten niet welke getallen meetellen voor significante cijfers.
A leerlingen denken dat alle 0’en niet meedoen met significante cijfers
B GOED
C leerlingen denken dat decimalen significante cijfers zijn
D leerlingen denken dat alle cijfers significante cijfers zijn

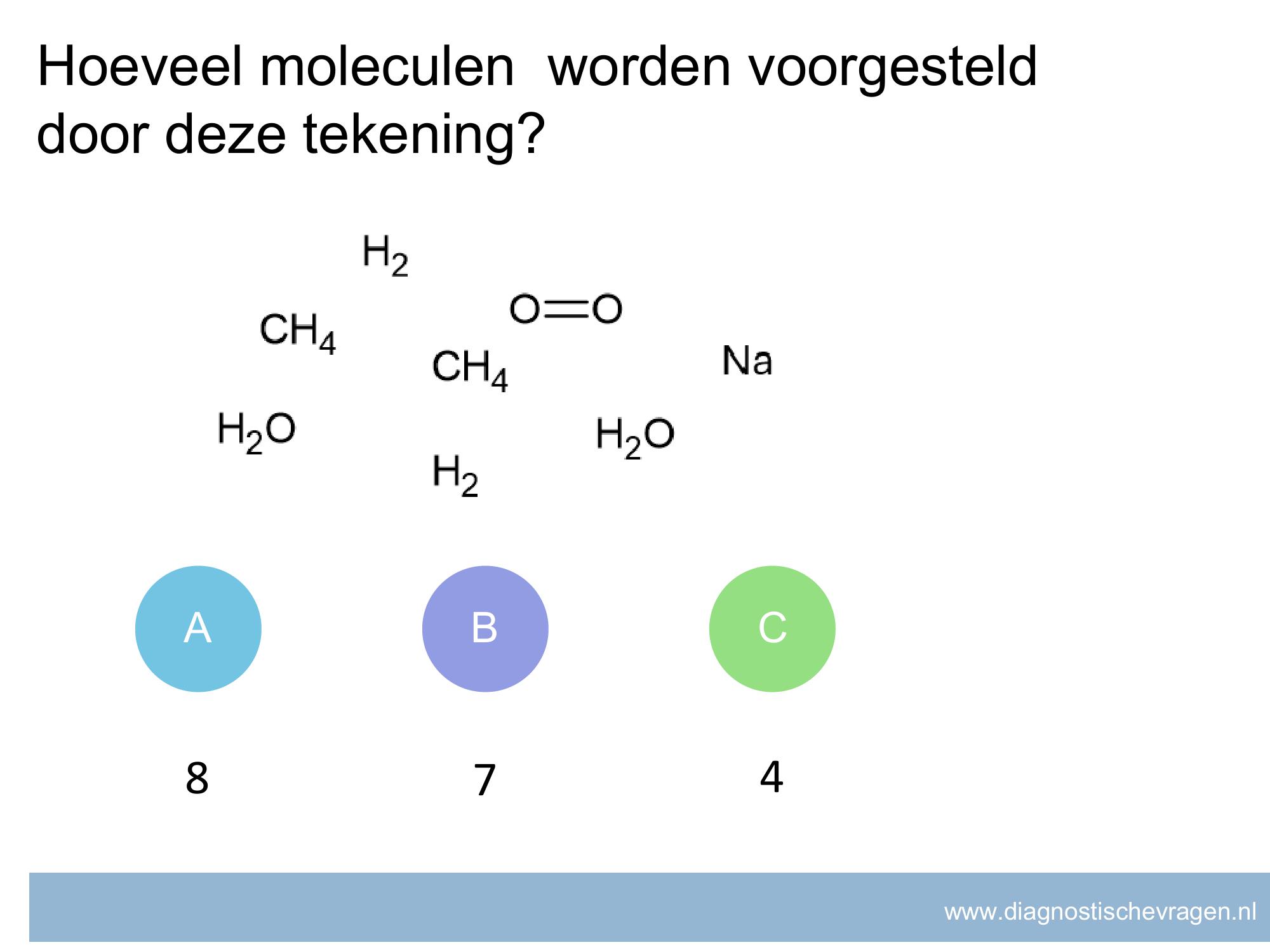
misvatting: leerlingen weten niet welke getallen meetellen voor significante cijfers.
A leerlingen denken dat alle cijfers achter de komma significante cijfers zijn
B leerlingen denken dat alle 0’en niet meedoen met significante cijfers
C leerlingen denken dat alleen cijfers voor de komma significante cijfers zijn
D GOED

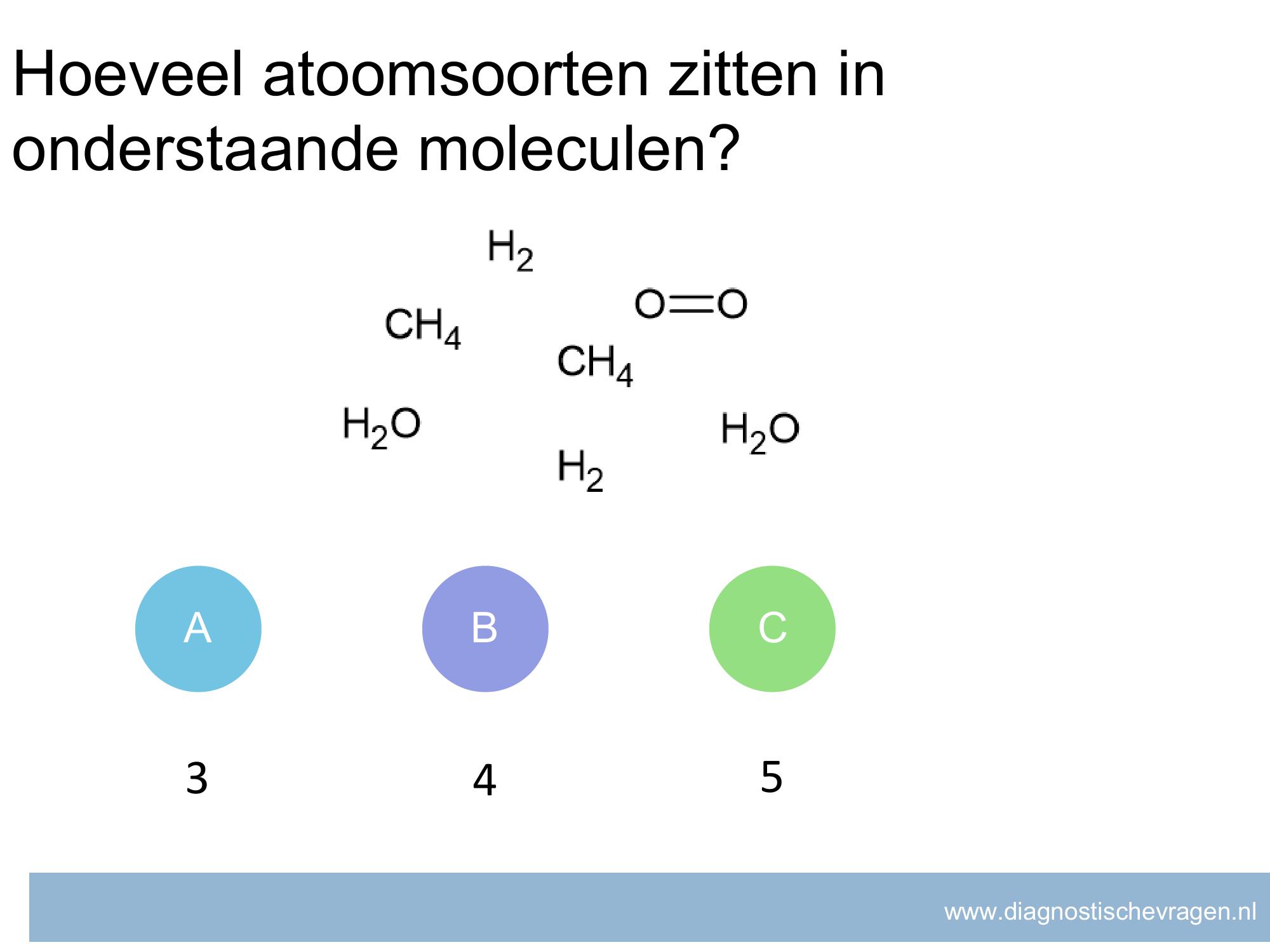
Misvatting: leerlingen weten het verschil tussen een meetwaarde en een telwaarde niet
A leerlingen zien over het hoofd dat 1 een telwaarde is en geen meetwaarde
B Leerlingen denk dat het standaard 2 significantie cijfers is
C GOED
D leerlingen geven antwoord in het grootste aantal significante cijfers van de gebruikte meetwaarden

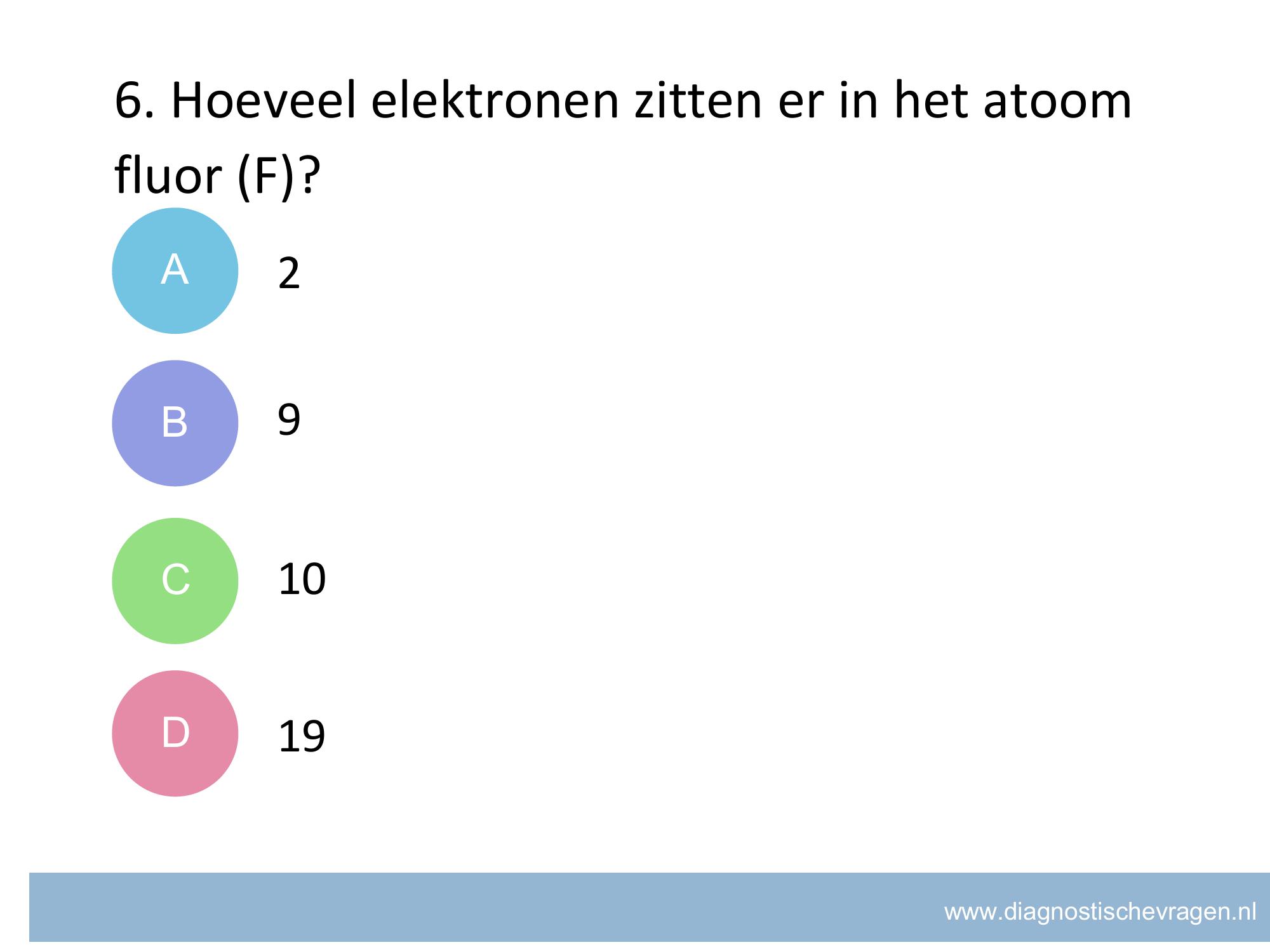
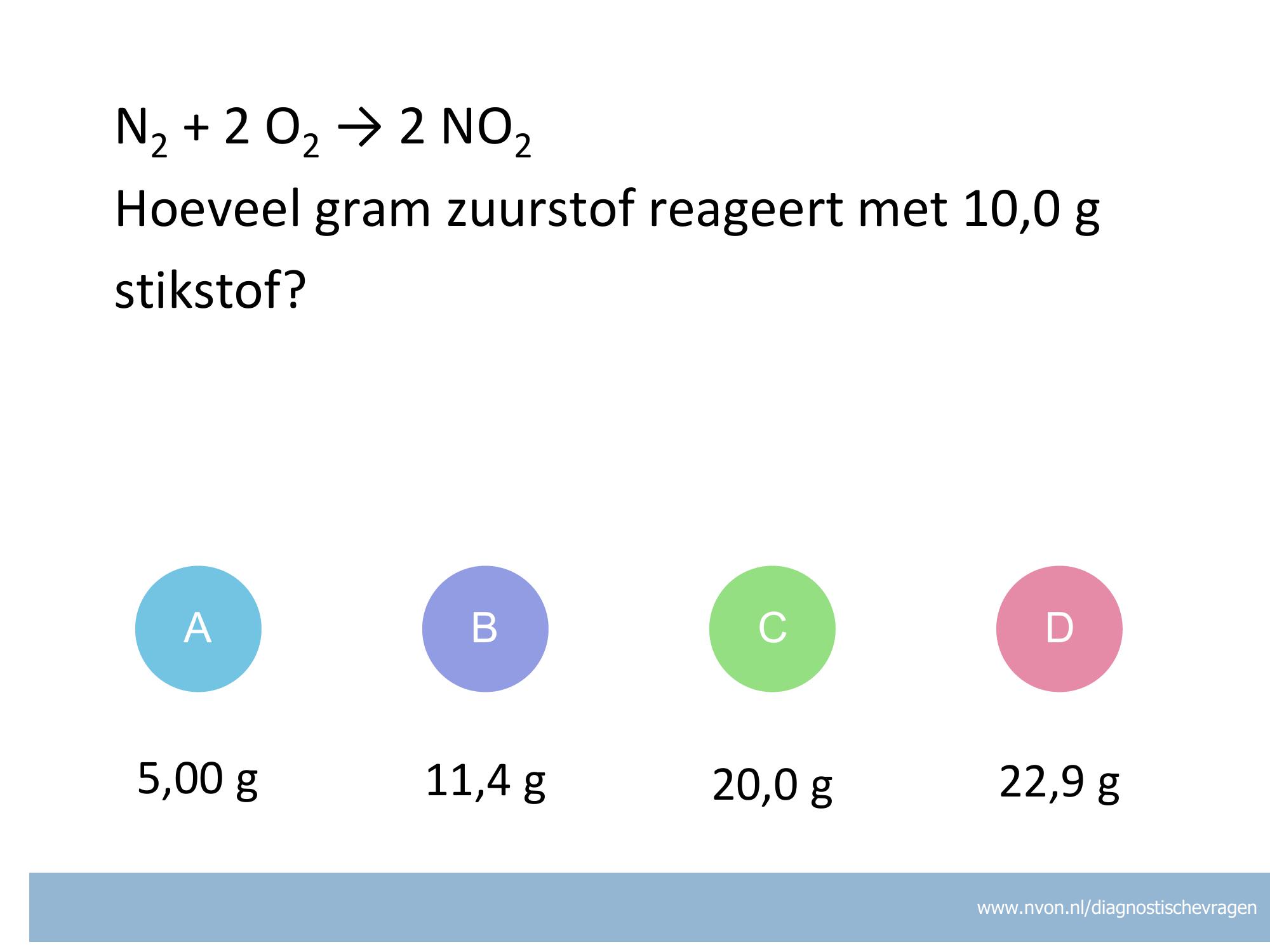
misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen van het antwoord van een berekening
A de leerling ziet 0 niet als significant cijfer
B de leerling kijkt naar het grootste aantal significante cijfers
C de leerling kijkt alleen naar het aantal decimalen voor x10
D GOED

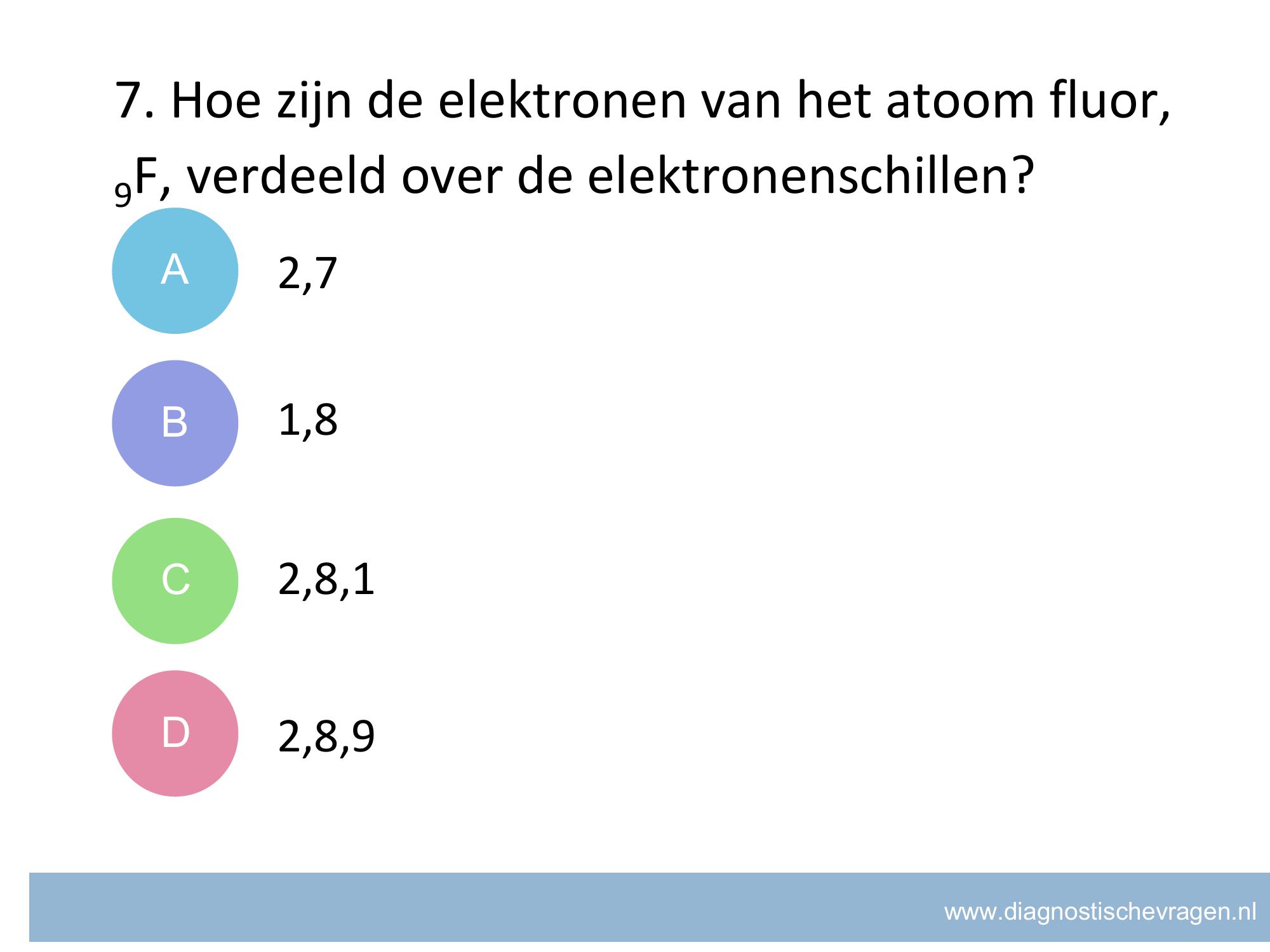
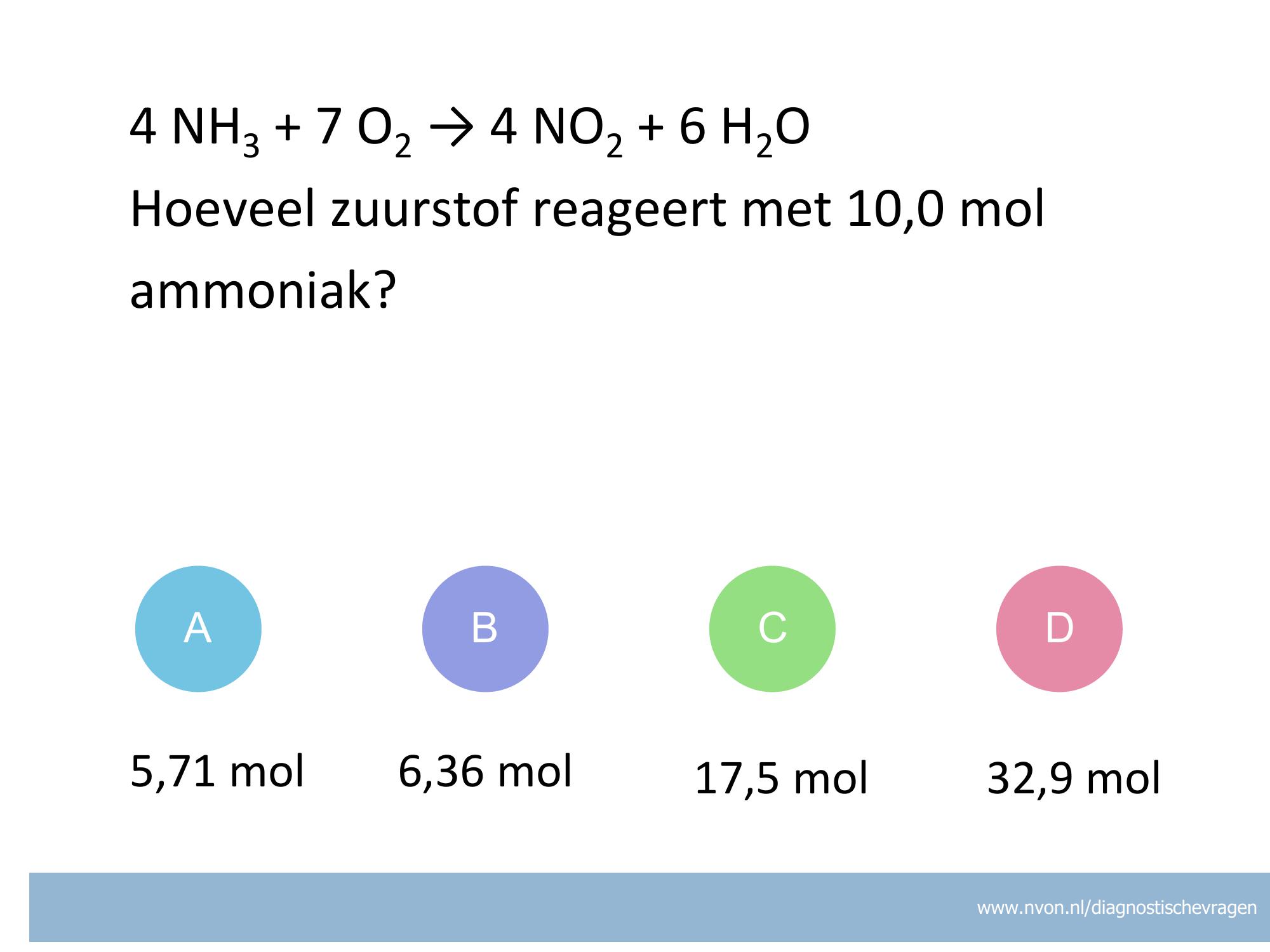
misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen van het antwoord van een berekening
A leerlingen denken dat een 0 geen significant cijfer kan zijn
B goed
C leerling noteert de gevonden waarde in de verkeerde wetenschappelijke notatie en verkeerd aantal cijfers.
D leerlingen geven antwoord in het grootste aantal significante cijfers van de gebruikte meetwaarden

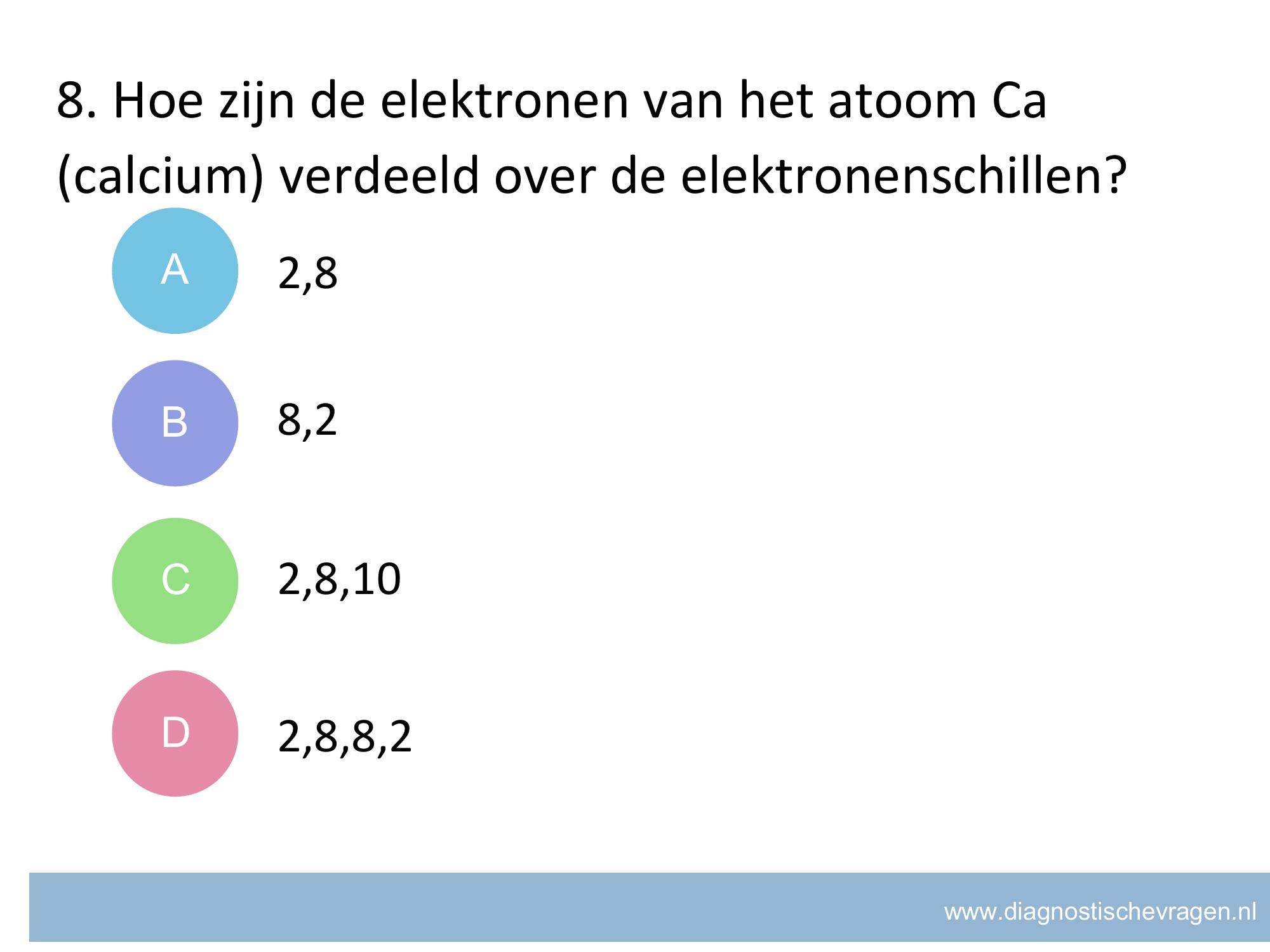
misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen van het antwoord van een berekening
A leerlingen denken dat een 0 geen significant cijfer kan zijn
B goed
C leerlingen geven antwoord in het grootste aantal significante cijfers van de gebruikte meetwaarden
D leerlingen kijken naar het aantal nullen in de meetwaarden en tellen die op

misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen bij een gemiddelde berekening en optellen
A leerlingen denken dat een 0 geen significant cijfer kan zijn of ziet de 3 als meetwaarde
B leerlingen passen alleen de regels voor vermenigvuldigen en delen toe en kappen het antwoord af.
C leerlingen passen alleen de regels voor vermenigvuldigen en delen toe
D GOED

misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen van het antwoord van een berekening
A leerlingen denken dat een 0 geen significant cijfer is
B De leerlingen denken dat de nullen achter de komma niet meetellen
C GOED
D leerlingen denken dat het aantal cijfers na de komma gelijk is aan het aantal significante cijfers

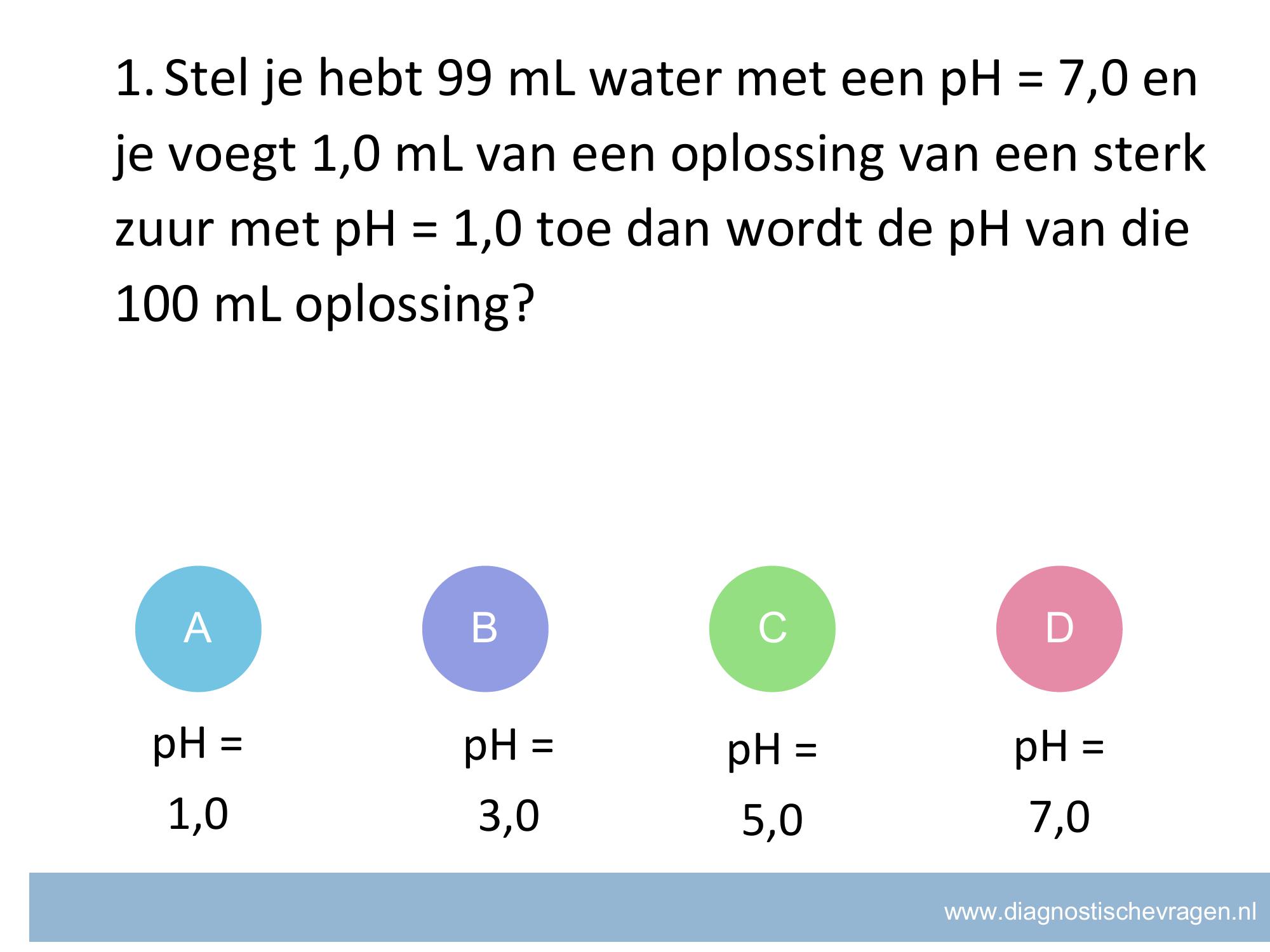
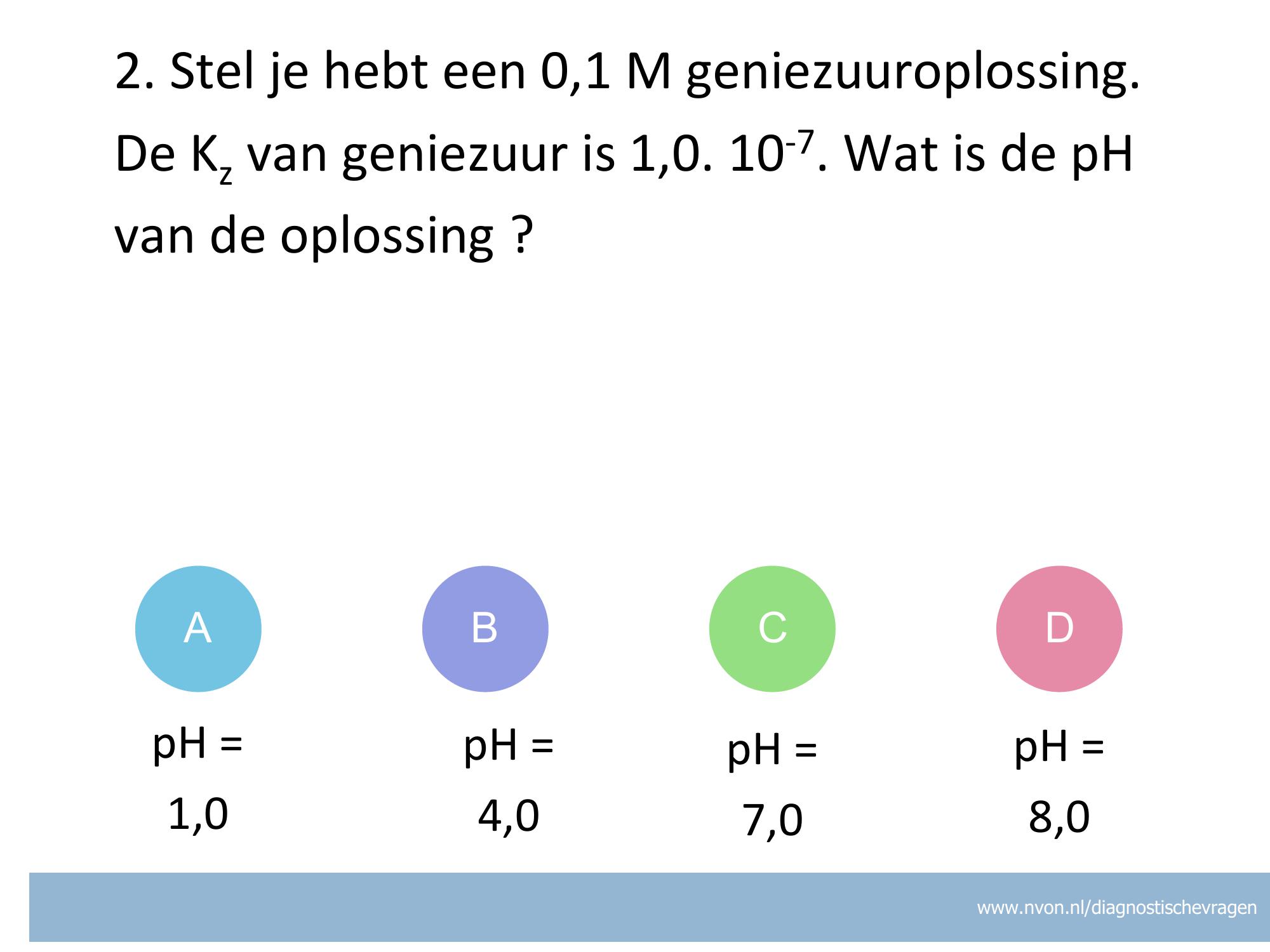
misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen bij een pH bepaling
A goed, aantal decimalen is de significantie
B De leerling denkt dat de 0 voor de 7 niet meetelt in bij het aantal decimalen
C De leerling heeft bij de berekening geen – log[..] gebruikt maar log [..]
D De leerling heeft bij de berekening geen – log[..] gebruikt maar log [..] en ook gaat het fout bij het aantal decimalen
auteur ABS
Verplicht invullen:

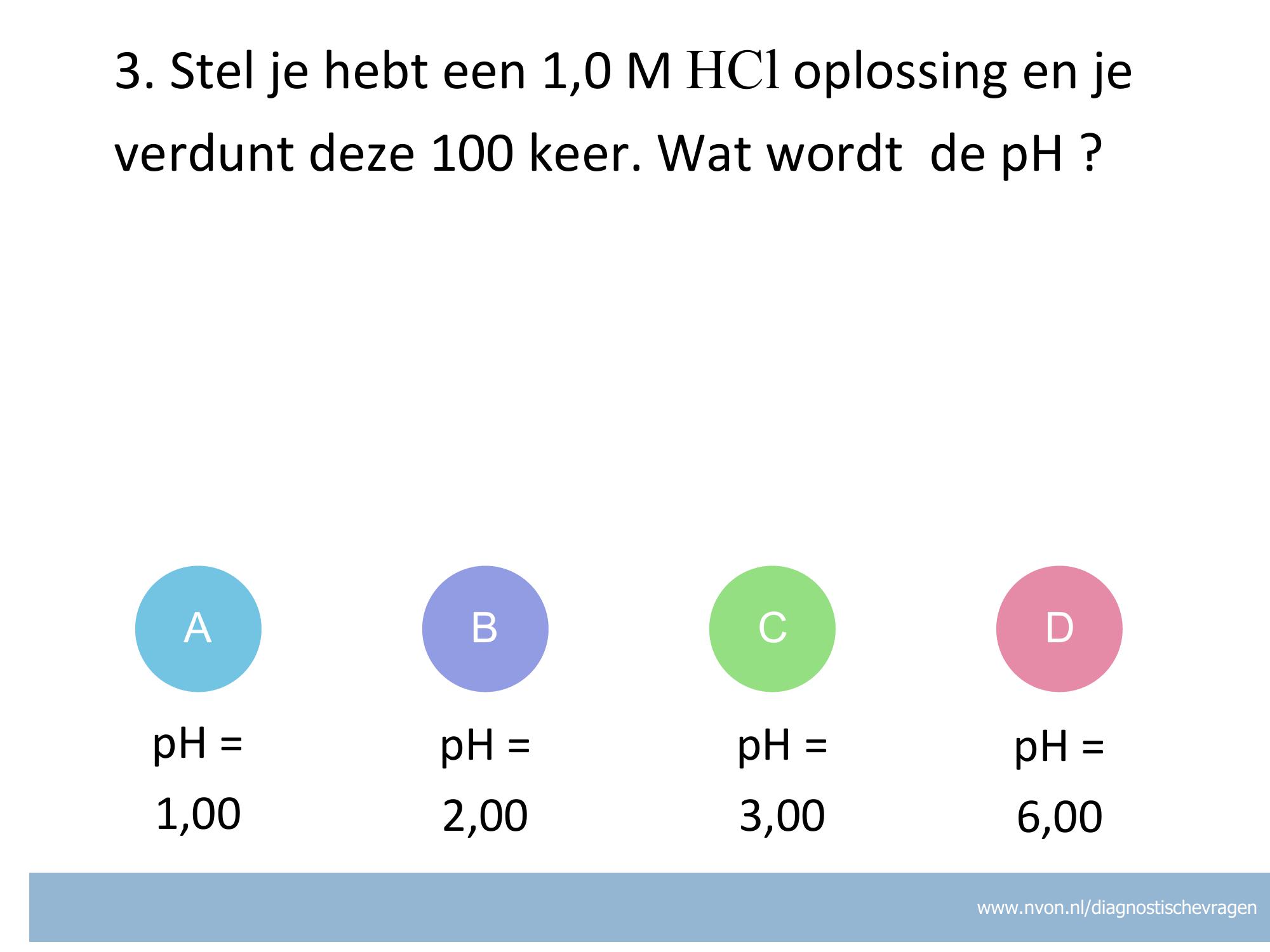
misvatting: leerlingen weten niet hoe zij het juiste aantal significante cijfers moeten bepalen bij een pH bepaling
A De leerling denkt dat het aantal decimalen goed is (op dezelfde manier dan met het log verhaal).
B De leerling heeft niet het juiste aantal significante cijfers
C Goed
D De leerling heeft niet het aantal juiste aantal cijfers.

De vragen en toelichtingen vallen onder een CC BY-SA 4.0 licentie https://creativecommons.org/licenses/by-sa/4.0