PH berekeningen
Scheikunde voor niveau vwo 6, vwo, vwo 5, vwo, 6, vwo, 5
PowerPoint met diagnostische vragen bij het onderwerp pH berekeningen voor VWO om snel formatief te handelen
ph, berekeningen, zuur, basen, zuren en basen, vwo, iol
Hieronder zie je de dia’s inclusief toelichting. Gebruik de knop hieronder om de presentatie (Powerpoint) te downloaden.
Download presentatie (.pptx)
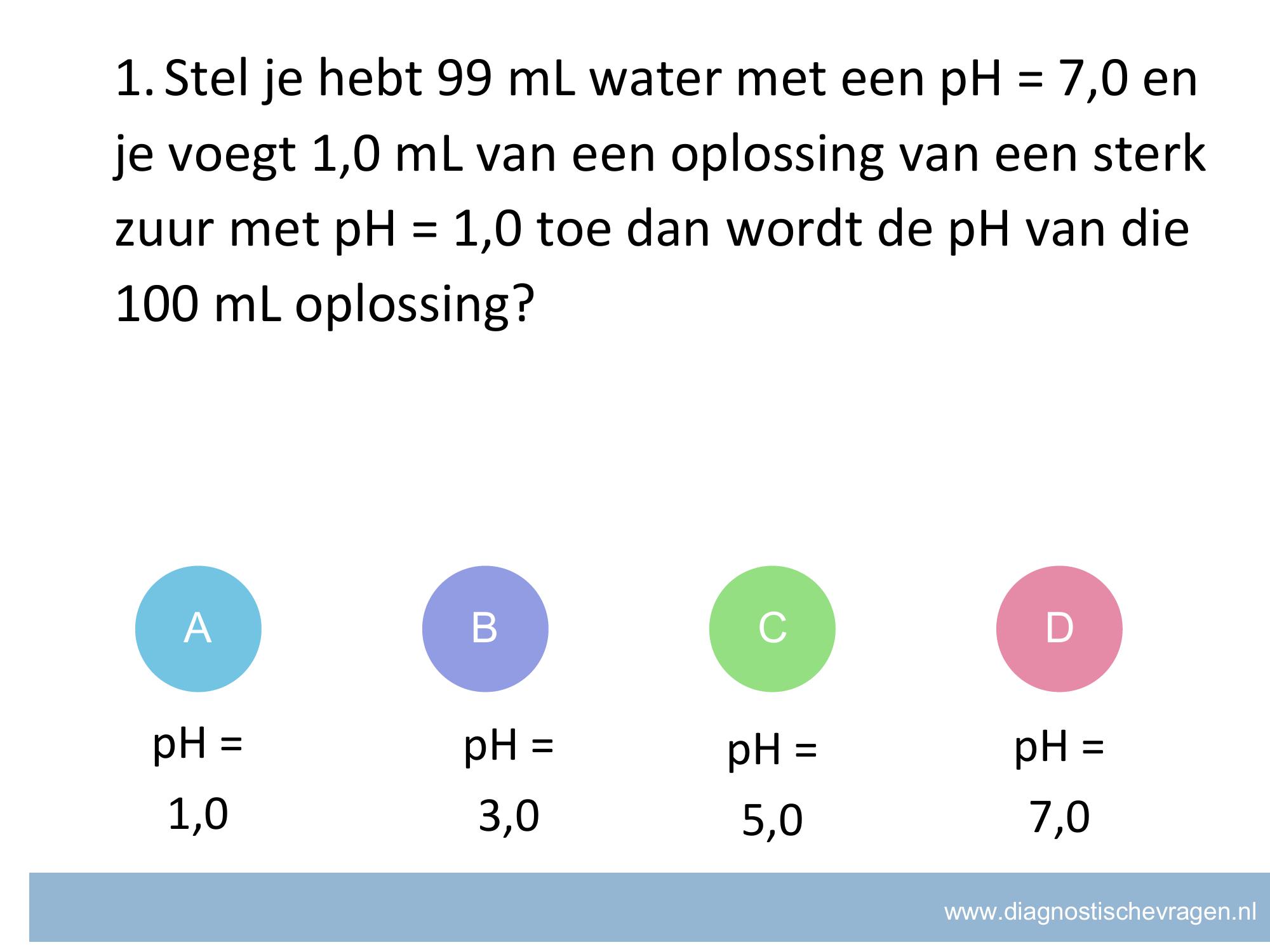
Misvatting: pH schaal omrekenen van [H+] naar pH bij verdunnen.
A Leerling denkt dat de oplossing de pH van de zure oplossing overneemt en een neutrale oplossing geen invloed heeft.
B GOED Van 1 mL pH 1,0 aanvullen naar 100 mL is 100 x verdunnen. Dus de pH gaat van 1 naar 3.
C Leerling denkt dat de pH van 7 2 eenheden naar beneden gaat bij het verdunnen.
D Leerling denk dat de pH met zo een kleine hoeveelheid niet naar beneden gaat.
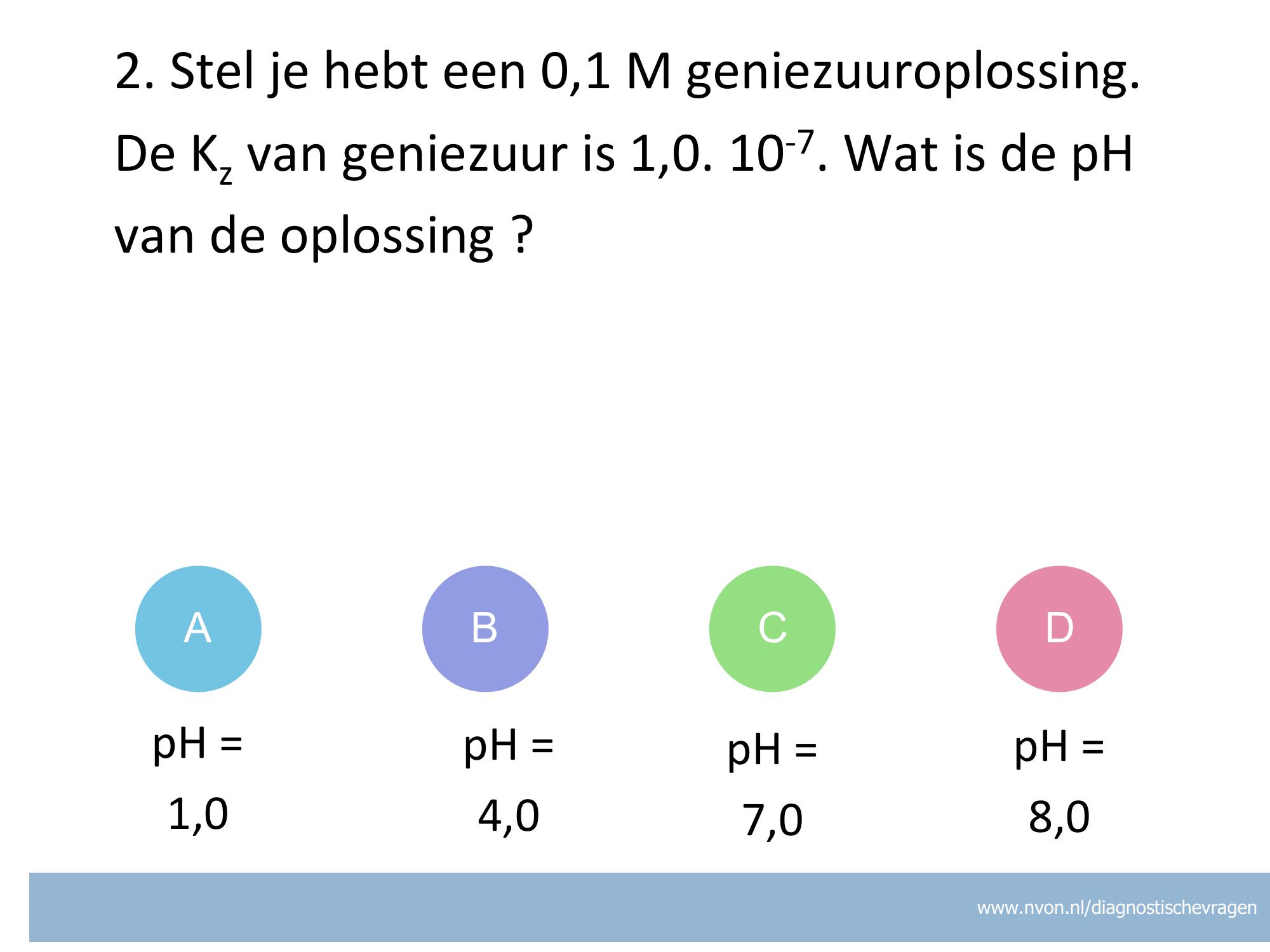
Misvatting: Conceptueel begrijpen van relatie tussen Kz en molariteit en pH.
A Leerling denkt dat H3O+ van zwak zuur gelijk is aan concentratie van dat zwakke zuur. = -log(0,1) = 1
B GOED opstellen vergelijking voor Kz en en inzicht dat H3O+ = A- en aanname dat HA= [HA]0
C Leerling denkt dat pH = -log (Kz)
D Leerling neemt -log(x^2)
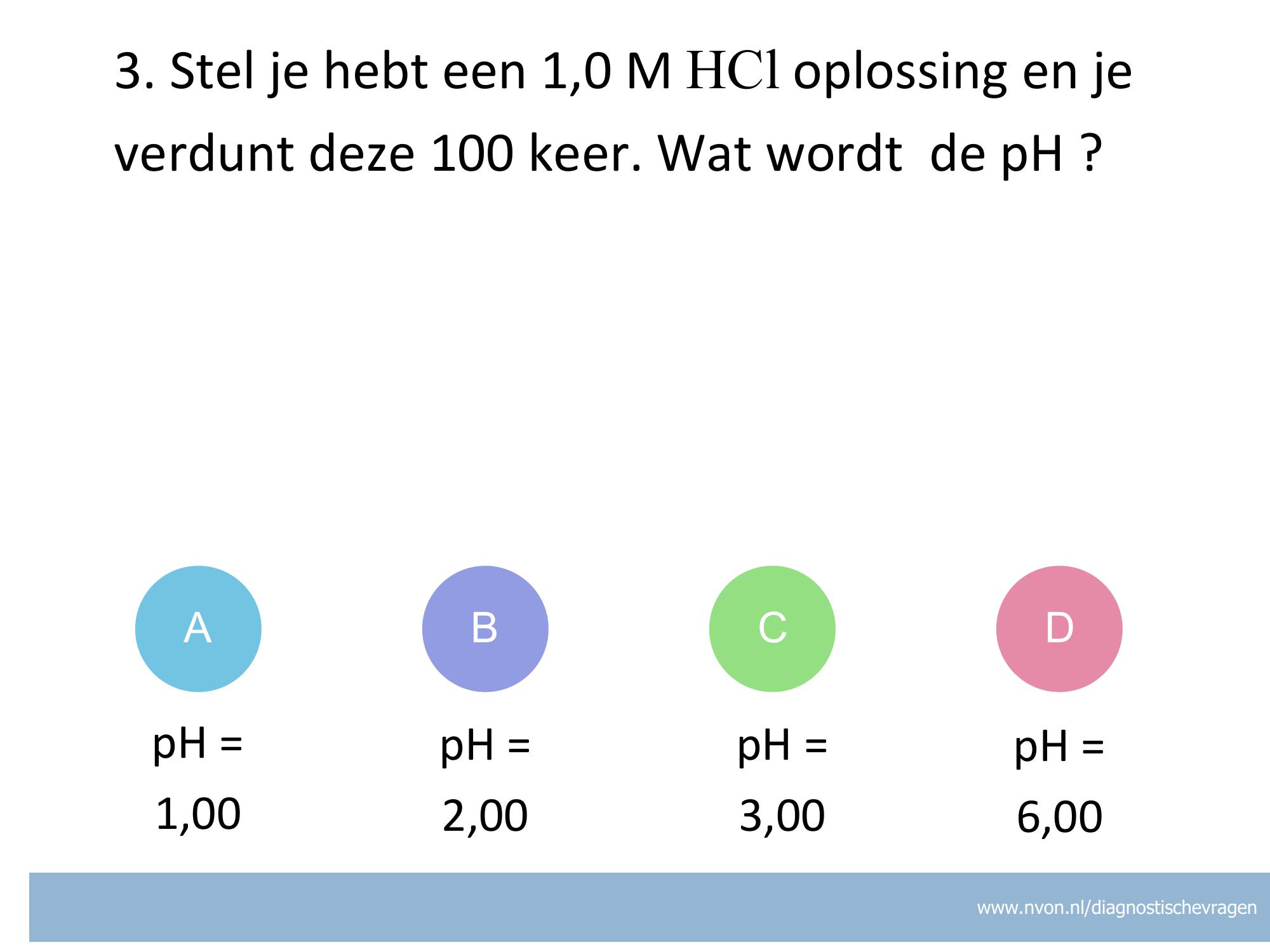
Misvatting: Onjuist inzicht in effect verdunnen op pH
A Onjuist, leerling heeft 100x verdunnen onjuist verwerkt.
B Juist, 100 x verdund => [] wordt 1 x 10-2. pH=2,00
C Onjuist, Leerling heeft gedacht dat 1,0 M een pH van 1 geeft
D Onjuist, ?

Misvatting: uitrekenen van de pH verschuiving van een buffer.
pH was eerst 8 want Z- = HZ, dus pH=pKz. Je voegt zuur toe, dus de pH gaat naar beneden. Hoeveel?
Correct antwoord. 1,0 ml x 10 M = 10,00 mmol H3O+. Z- wordt dan 0,500 – 0,01=0,490 en HZ wordt dan 0,500 + 0,01 = 0,51
1,00 . 10^-8 = (0,501/0,499)*[H3O+] => [H3O+] = 1,00. 10^-8 *(0,49/0,51) = 1,04 . 10^-8 => pH =7,98
A GOED
B Leerling draait HZ en Z- om
C leerling heeft initieele pH buffer onjuist berekend
D zie C

Misvatting: Onjuist beeld van concentraties bij verschillende pH’s
A De leerling heeft geen rekening met verdunning gehouden
B GOED, 1000 x verdund dus 3 pH-eenheden lager
C De leerling heeft de resulterende concentratie H3O+ niet goed berekend
D De leerling heeft het effect van loog op de pH verwaarloosd

Misvatting: Onjuist inzicht in rol verhouding HZ:Z- op pH buffer
A De leerling heeft geen idee?
B De leerling heeft de verhouding Z-:HZ omgekeerd
C De leerling is uitgegaan van een 1:1 verhouding
D GOED, verhouding 1:0,5 => pH= -log Kz/2 = 6,3

De vragen en toelichtingen vallen onder een CC BY-SA 4.0 licentie https://creativecommons.org/licenses/by-sa/4.0
